Введение
Пародонтит и сахарный диабет (СД) – это два широко распространенных хронических заболевания, которые значительно ухудшают самочувствие и общее состояние здоровья [1]. СД, в частности, представляет собой группу метаболических нарушений, возникающих из-за проблем с выработкой или использованием инсулина. Ключевым признаком диабета является повышенный уровень сахара в крови, который, в свою очередь, может привести к серьезным долгосрочным осложнениям, повышению смертности и сокращению продолжительности жизни [2].
Пациенты с диабетом более восприимчивы к пародонтиту, и наоборот, пародонтит может усугубить состояние больных с СД. Согласно последним данным Международной диабетической Федерации, в 2021 году распространенность СД в мире достигла 529 млн человек. Предполагается, что к 2045 году число больных СД достигнет 783 млн человек. Высокий уровень заболеваемости, инвалидности, смертности и стремительный рост СД создают серьёзные проблемы для системы здравоохранения. Хронические заболевания, связанные с СД, могут поражать различные органы, в том числе вызывая микро- и макрососудистые заболевания (диабетическая нефропатия, периферическая диабетическая нейропатия и диабетическая ретинопатия, что в конечном итоге может привести к потере зрения) [3].
Пародонтит – это хроническое воспалительное заболевание, при котором происходит разрушение тканей пародонта и уменьшение объёма альвеолярной кости и альвеолярного гребня, и при отсутствии должного лечения приводит к потере зубов. У людей с СД 1 типа риск развития пародонтита выше, чем у людей без диабета [4-6]. Исследования показали, что распространенность пародонтита у пациентов с СД 1 типа может варьироваться от 10% до 46% в зависимости от возраста и стажа заболевания [7, 8]. СД 2 типа встречается чаще и как правило, распространенность пародонтита у данных пациентов выше и составляет от 30% до 60% [9, 10]. При игнорировании первичных признаков пародонтита могут также развиться и другие осложнения, например, язвенная болезнь желудка, почечная недостаточность, ишемическая болезнь сердца, эмфизема лёгких, пневмония и т.д.
Одним из характерных признаков пародонтита является наличие пародонтального кармана, который может быть диагностирован с помощью зондирования. По глубине пародонтального кармана выделяют три основных степени тяжести развития пародонтита: легкая, средняя, тяжелая, которые позволяют определить уровень разрушения тканей (рис. 1) [11].
Диабет и пародонтит – независимо связаны и опосредованы сложными взаимодействиями между микробиомом, воспалением, иммунным ответом организма, окислительным стрессом, генетикой и другими факторами. Точные молекулярные механизмы, связывающие их, а также пути взаимодействия между диабетом и изменениями в тканях пародонта до конца не изучены.
Целью данного исследования является анализ данных о молекулярных патофизиологических изменениях, связанных с пародонтитом и СД.
Материалы и методы исследования
Был проведён обзор и анализ литературы, в том числе из базы данных PubMed, eLibrary.
Результаты исследования и их обсуждение
В последние годы многие исследования показали, что СД может изменить состав и биоразнообразие поддесневого микробиома. Как правило плохой гликемический контроль и длительная гипергликемия были вовлечены в качестве факторов риска заболеваний пародонта (рис. 2) [1, 12].
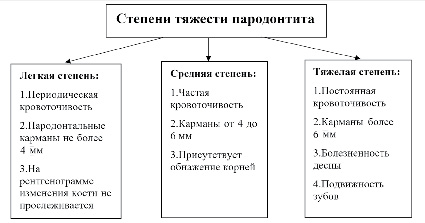
Рис. 1. Степени тяжести развития пародонтита (Н.Н. Аболмасова, А.И. Николаева) [11]
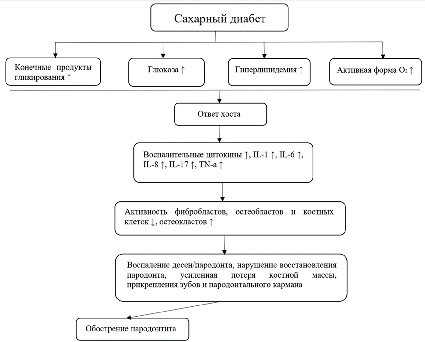
Рис 2. Влияние гликемического контроля и гипергликемии на развитие пародонтита Источник: составлено авторами: Chung Y.L., Lee J.J., Chien H.H., Chang M.C., Jeng J.H. [1]
Пациенты с СД 2 типа более восприимчивы к пародонтальным патогенам и имеют более высокий риск развития пародонтита. Диабет повышает уровень глюкозы, конечных продуктов гликирования, гиперлипидемии и активных форм кислорода в тканях пародонта, что приводит к усилению воспаления и влияет на фибробласты, остеобласты и остеокласты, тем самым усиливая воспаление тканей, образование пародонтальных карманов и резорбцию альвеолярной кости [12, 13].
СД может изменять микробиоту полости рта, и этот эффект частично обращается вспять только за счет введения антител медиаторов воспаления IL-17, RANKL и IL-6, что указывает на то, что СД, бактериальный состав полости рта и воспаление имеют сильную корреляцию [12].
Воспаление является еще одним ключевым фактором связи между СД и пародонтитом, так как оба состояния ассоциируются с выраженными воспалительными процессами [14]. Воспаление – это защитная реакция тканей пародонта на бактериальные вредные раздражители, процесс, направленный на восстановление баланса путем устранения вредных раздражителей, таких как патогены. Развитие диабета 1 типа часто связано с нарушениями в иммунной регуляции, что приводит к активации врожденной иммунной системы и увеличению числа аутореактивных Т- и В-лимфоцитов, вырабатывающих аутоантитела. Для развития диабета 2 типа характерна неспособность островковых β-клеток поджелудочной железы компенсировать высокие уровни глюкозы, что обусловлено снижением инкретинового ответа и увеличением секреции глюкагона. Функциональные нарушения естественных киллеров и В-клеток, а также изменения в пролиферации макрофагов и Т-клеток способствуют прогрессированию СД 2 типа [15].
Хотя микробный дисбиоз непосредственно влияет на ткани пародонта, микроорганизмы также играют важную роль в усилении воспалительной реакции восприимчивых хозяев, образуя устойчивые биопленки на зубах в процессе прогрессирования пародонтита. Накопление зубного налета вызывает воспаление тканей пародонта, что изменяет окружающую среду и способствует росту грамотрицательных бактерий. Дальнейшие неконтролируемые воспалительные и иммунные реакции значительно ускоряют разрушение тканей [16].
Нейтрофилы являются важным компонентом врожденного иммунитета, формируя первую эффективную линию защиты хозяина от пародонтальных бактерий. Нейтрофильный гомеостаз может поддерживать баланс между защитой и разрушением организма, и любой дисбаланс может привести к повреждению тканей пародонта [12]. Дисфункциональные нейтрофилы могут вызывать повреждение тканей пародонта посредством высвобождения медиаторов воспаления или ферментов, разрушающих ткани. У пациентов с СД и плохим гликемическим контролем нейтрофилы могут быть активированы заранее, чтобы увеличить повреждение пародонта за счет повышения активности протеинкиназы С. Плохо функционирующие нейтрофилы могут усиливать повреждение тканей, производить больше супероксидных и провоспалительных цитокинов, а также хемокинов и увеличивать количество нейтрофилов в ткани пародонта. Кроме того, уровни кальпротектина, основного цитоплазматического белка в нейтрофилах, значительно выше у пациентов с пародонтитом и СД 2 типа, чем у пациентов с хроническим пародонтитом [17].
Макрофаги являются еще одним типом клеток, связанным с иммунным ответом и, как полагают, способствуют развитию пародонтита. СД может увеличивать поляризацию провоспалительного фенотипа М1 макрофагов, тем самым увеличивая восприимчивость и тяжесть заболевания пародонта, а количество макрофагов противовоспалительного фенотипа М2 соответственно уменьшается. Классические пути активируют провоспалительные макрофаги M1, которые участвуют в производстве воспаления, в то время как противовоспалительные макрофаги M2 участвуют в подавлении воспаления. Системные метаболические изменения, вызванные гипергликемией, при СД, и резистентностью к инсулину, могут изменить поляризацию и функцию макрофагов, усилить миелопоэз и привести к увеличению высвобождения моноцитов, которые являются предшественниками макрофагов. Нейтрофилы уничтожают пародонтальные микроорганизмы, фагоцитируя их или высвобождая нейтрофильные внеклеточные ловушки, а затем запускают апоптоз и немедленный эффероцитоз, наряду с этим запускаются макрофаги, чтобы предотвратить большее повреждение тканей пародонта. Тем не менее, хроническое расстройство у пациентов с СД обычно приводит к длительному воспалению и стойкости нейтрофилов и макрофагов, что усугубляет воспаление пародонта [18, 19].
В дополнение к воспалительной реакции, опосредованной пародонтальными патогенами, и последующей продукцией чрезмерного количества активных форм кислорода (АФК), вызванного нейтрофилами, некоторые данные свидетельствуют о том, что гипергликемия, вызванная диабетом, также может приводить к накоплению продуктов окислительного стресса в ткани пародонта. Высокие уровни гликемии индуцируют АФК путем чрезмерной активации полиольных путей, гексозаминовых путей и сигнальных путей рецепторов конечных продуктов неферментативного гликирования (AGE/RAGE), увеличивая образование AGE, митохондриальную дисфункцию и значительное увеличение окислительных веществ [19-21].
Являясь одним из основных механизмов заболевания, AGE/RAGE являются основным связующим звеном между диабетом и его осложнениями. Исследования показывают, что при хроническом пародонтите, связанном с сахарным диабетом, накопленные AGE/RAGE в пародонте увеличиваются. Синергетический эффект и AGE/RAGE может вызвать повреждение пародонта при СД. AGE/RAGE усиливают клеточную аутофагию, активируя сигнальный путь (ERK) и изменяя проницаемость клеточных мембран, что увеличивает уровень окислительного стресса в пародонте. Исследования показывают, что AGE/RAGE, накопленные в пародонтальной ткани, способствуют выработке воспалительных цитокинов, таких как IL-6 и IL-8. Кроме того, КПГ и TNF-α могут усиливать действие окислительных веществ и снижать остеогенную дифференцировку. Чрезмерные АФК, возникающие при диабете, приводят к повреждению теломер стволовых клеток периодонтальной связки (PDLSC) и нарушают регенерацию пародонтальных тканей [22, 23].
Основываясь на выше сказанном, мы обнаруживаем связь между СД и пародонтитом.
Выводы
Таким образом, обобщив информацию о взаимосвязи и механизмах взаимодействия между СД и пародонтитом, можно сделать вывод, что СД является основным фактором риска развития пародонтита и может повышать патогенность микробиоты пародонтита.
Более глубокое понимание механизмов связи между СД и пародонтитом поможет лучше объяснить взаимное влияние метаболических и воспалительных заболеваний и обеспечить теоретическую основу для поиска новых системных комплексных методов лечения пародонтита и СД, а также блокировать их взаимосвязь.
Взаимосвязь между пародонтитом и СД является сложным и многогранным явлением, и понимание взаимодействия этих двух хронических заболеваний имеет решающее значение для разработки эффективных стратегий профилактики и лечения.

