Дыхание обеспечивает поддержание нормального уровня газового состава крови и наиболее важных показателей. К таковым относят парциальное давления кислорода и углекислого газа артериальной крови. В тесной связи с этими показателями находится концентрация водородных ионов, которые определяют уровень РН. Нормальное протекание процессов тканевого и внешнего дыхания в различных условиях среды поддерживается с помощью нервных регуляторных механизмов, входящих в состав дыхательной системы. Эти механизмы обеспечивают поступление афферентной импульсации, ее переработку в соответствующем центре и ответ в виде эффекторных воздействий. Именно центральный нервный аппарат объединяет отдельные части дыхательной системы в единую функциональную систему. Центральный аппарат представляет собой сложную систему, включающую фрагменты спинного мозга, продолговатого мозга и отделы коры больших полушарий мозга. Стоит отметить, что для полноценного функционирования дыхательного центра необходимы проводники, особые нервные клетки – дыхательные нейроны, благодаря которым реализуются все многообразие изменений дыхания на разных его этапах. Сегодня выделяют несколько групп специализированных классов нейронов однотипных по функции. Дорсальная и вентральная дыхательная группа, комплекс Бетцингера, комплекс пре-Бетцингера и мостовая дыхательная группа нейронов [1, с. 138].
Весь дыхательный цикл включает две фазы: вдоха и выдоха. И реализуется непосредственно в 4 такта. Каждый такт во времени занимает примерно половину фазы. В начале первого такта отмечают нарастание альвеолярного и внутриплеврального давления, а также объема легких, что сопровождается увеличением скорости потока воздуха. Затем идет второй такт, включающий в себя значительное увеличение альвеолярного и внутриплеврального давления вместе с увеличением легких при значительном уменьшении скорости потока воздуха. Третий такт сопровождается резким возрастанием альвеолярного и внутриплеврального давления в сочетании с падением скорости потока воздуха и уменьшения объема легких. Завершающий такт предполагает полное возвращение к исходным величинам альвеолярного и внутриплеврального давления, объема легких и скорости потока воздуха [2, с. 32].
Генерация дыхательного ритма осуществляется в структурах продолговатого мозга и реализуется благодаря реципрокным взаимосвязям между нейронами инспираторной и экспираторной групп. Важно сказать, что дыхательный ритм формируется в результате взаимодействия между функционально различными группами нейронов дыхательной системы. Проанализировав импульсную активность нейронов дыхательного центра, было выявлено, что импульсация преобладающей части дыхательных нейронов начинается преимущественно в начале вдоха, а заканчивается на разных этапах дыхательного цикла. Именно непрерывно усиливающаяся активность инспираторных нейронов генерирует необходимый уровень объемной скорости воздушного потока в системе дыхания. Следует иметь ввиду тот факт, что в дыхательном центре активность нейронов ни на секунду не останавливается. То есть происходит последовательное циклическое возбуждение одних и торможение других групп нейронов [3, с. 27].
Под воздействием различных факторов на дыхательный центр, может возникать либо возбуждение определенной совокупности дыхательных нейронов, либо их торможение, изменяя при этом динамику системы в целом. Это может проявляться в виде усиления активности системы дыхания или же приводить к преходящему нарушению и кратковременному или полному прекращению ее ритмической деятельности.
Цель исследования – на основании данных литературы оценить характер влияния различных факторов, вызывающих нарушения, изменения и повреждения дыхательного центра.
Материалы и методы исследования
Проведен анализ литературных данных, охватывающих информацию о влиянии факторов различного генеза, которые могут выступать условием развития патологического дыхания и патологических явлений в дыхательном центре.
Результаты исследования и их обсуждение
Различные классы дыхательных нейронов получают волны периодического возбуждения и торможения, которые создаются посредством фазической передачи в синапсах. Отмечают влияние возбуждающих и тормозных эндогенных аминокислот, являющихся нейрохимической основой этих быстрых мембранных процессов. Таким образом возбуждающие аминокислоты, действуя через N-метил-D -аспартатные рецепторы на уровне продолговатого мозга, стимулируют в генерацию дыхательного ритма и участвуют в механизмах переключения фаз дыхательного цикла.
К тормозным аминокислотам, подавляющим передачу между дыхательными нейронами, относят гамма-аминомасляную кислоту и глицин. Выделяются они в определенной последовательности и формируют ритмическую деятельность дыхательных нейронов. Глицин, воздействуя на определенные рецепторы, реализует функцию быстрого выключения фазы вдоха и выдоха. Происходит это действие через ранние экспираторные нейроны для вдоха и через ранние инспираторные для выдоха. Тормозные синаптические влияния на дыхательные нейроны реализуются при участии ГАМКа-рецепторов, сопряженных с хлорными каналами мембран клеток. Эта аминокислота пролонгирует течение вдоха и выдоха до их окончания. Вдох через поздние инспираторные и выдох через поздние экспираторные нейроны [4, с. 115-119]. Корреляционный анализ показал зависимость силы дыхательных мышц и активности дыхательного центра от функциональных характеристик системы дыхания — величины и изменения соотношений легочных объемов, состояния проходимости дыхательных путей и легочного газообмена [5, с. 36; 6, с. 46; 7, с. 1].
Любое повреждение дыхательного центра неминуемо приведет к гипоксии. Она может являться как следствием, так и условием для развития патологического дыхания. Регистрируются случаи остановки дыхания во сне вследствие развития обструктивного апноэ. Это наталкивает на поиск механизмов, приводящих к данному нарушению. Во время сна изменяется тонус ретикулярной формации мозга, а, следовательно, и уровень восприятия и обработки сигналов вследствие формирования новых нейромедиаторных взаимоотношений клеток в центральной нервной системе. В связи с этим особое внимание привлекают группы нейронов вентральных отделов ствола головного мозга. Отмечается, что на поверхности этих областей ствола мозга расположены рецепторные структуры, реагирующие в большей степени на сдвиги концентрации водородных ионов и изменение содержания углекислого газа во внутренней среде организма.
Чтобы подробнее осветить механизм воздействия эндогенных веществ на дыхательный центр, следует проанализировать ультраструктурные особенности строения вентральных отделов ствола головного мозга. Вблизи стенки микрососуда располагается большое количество аксонов и митохондрий, которые располагаются в цитоплазме нейронов, глиальных клеток, аксоплазме. Расстояние от микрососуда до аксонов и митохондрий составляет примерно несколько микрон. Следовательно, процесс диффузии кислорода из крови в структуры мозга или, наоборот, углекислого газа из тканей мозга в кровь происходит за считанные секунды или даже миллисекунды. В другом участке вентрального отдела ствола были получены следующие данные микроскопического исследования. Между стенкой капилляра и ядром астроцита в цитоплазме отчетливо различимы цистерны эндоплазматического ретикулума и митохондрия. Так же замечали скопления аксонов с тонкой характерной миелиновой оболочкой. Помимо этого, при рассмотрении отдельные аксоны распределялись по всему полю зрения, в том числе и вблизи стенки микрососуда, что было отмечено ранее. Такое расположение нейрональных и глиальных структур типично для ткани головного мозга и служит необходимым условием, чтобы иметь возможность предотвратить возникновение ситуаций, сопровождающихся гипоксией и ишемией ткани мозга при недостатке во внутренней среде организма кислорода. В области вентральных отделов ствола мозга располагаются хемочувствительные ультраструктуры, способствующие оптимизации процесса восприятия возросшего количества водородных ионов и молекул углекислого газа в условиях гипоксии или гиперкапнии. Миелинизированные отростки нервных клеток, располагающиеся вблизи микрососудов, выполняют функции межнейронной интеграции в данной области мозга и способны передавать информацию от хеморецепторных ультраструктурных элементов к нейронам витальных центров. Интересен тот факт, что по ходу ствола головного мозга тянутся ликворопроводящие пути к спинному мозгу и это важно для хемосенсорных элементов этих отделов мозга. Они в свою очередь способны выполнять интегративные функции, воспринимая напряжение углекислого газа, содержание водородных ионов и кислорода в ликворе, тканях мозга и вблизи микрососудов. Но самую достоверную информацию о недостатке кислорода во внутренней среде организма витальные центры мозга получают от сосудистых хеморецепторов, рецепторов каротидного тельца. На уровне вентральных отделов ствола мозга информация в виде импульсов сопоставляется с активной сигнализацией от центральных хеморецепторов. Данные рецепторы в процессе эволюции постепенно повышали чувствительность к изменениям уровней углекислого газа и концентрации протонов водорода, а они являются теми раздражителями, интенсивность которых определяется процессами непосредственно на уровне ткани мозга. Стоит отметить, что рядом с вентральной поверхностью продолговатого мозга уровень карбоангидразы значительно высок. Этот фермент определяет уровень водородных ионов и СО2 в тканях организма. У водород-ионов есть тоже интересная особенность, заключающаяся в туннелировании их в живых клетках, что определяет стремительность передачи информации о сдвиге концентрации этих ионов в тканях [8, с. 56-59].
Нельзя не отметить действие ишемических факторов в развитии гипоксии. Это так называемая циркуляторная гипоксия, сопровождающаяся нарушением доставки кислорода к тканям и снижение парциального давления кислорода в условиях его нормального содержания в крови. Одним из видов циркуляторной гипоксии является сосудистая форма. Данная форма развивается при патологии сосудистого русла или нарушении ее проходимости. Такое возможно при развитии атеросклероза, коарктации аорты, тромбозе.
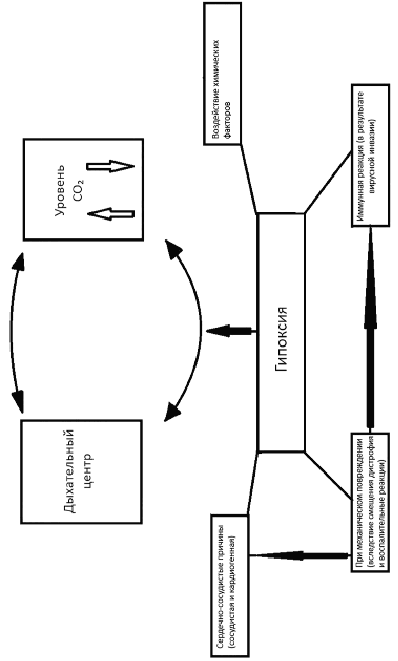
Комплексное влияние поражающих факторов на дыхательный центр
Еще одним видом является кардиогенная гипоксия, возникающая при неспособности сердца перекачивать и доставлять органам необходимое количество кислорода. Эта форма ярко проявляется при врожденных или приобретенных пороках сердца и его клапанов, различных формах аритмии и при повышенном сосудистом сопротивлении току крови (рисунок) [9, с. 48; 10, с. 89]. Так или иначе любая из форм циркуляторной гипоксии является следствием ишемии тканей головного мозга, которая представляет собой патофизиологический процесс, включающий развитие гипоэргоза с нарушением активного транспорта необходимых ионов через мембраны, отклонения в функции медиаторов возбуждения и торможения в структурах мозга, возрастание уровня ионизированного кальция. В результате церебральной ишемии возникает острый недостаток поступления кислорода к мозгу, угнетение аэробного пути утилизации глюкозы и замена его на гликолиз. Так же снижение синтеза энергии и изменение кислотно-основного состояния. Развивающийся ацидоз способствует дальнейшему угнетению метаболических процессов с образованием клеточного отека. Изменяется проницаемость мембран нейронов и их физико-химические свойства за счет цитотоксического действия. Весь процесс усугубляется активацией свободнорадикального окисления. Совокупность этих патологических реакций, возникших на фоне гипоксии, приводит к смерти головного мозга [11, с. 363]. В свою очередь, одним из важнейших является поражение дыхательного центра под действием биологического фактора, к которому можно отнести взаимодействие с вирусными частицами. Это явление было хорошо исследовано в связи с эпидемией COVID-19. Большое количество клинических исследований говорят о соответствующая инфекция сопровождается прямым или косвенным поражением головного мозга, в том числе и дыхательного центра, в дополнение к острым респираторным синдромам.
Проникновение вируса в клетки происходит главным образом в связи с клеточным рецептором ангиотензинпревращающего фермента 2 (АСЕ2), белком, экспрессируемым совместно с мембрано-связанной сериновой протеазой 2 в эндотелиальных клетках всего организма. Наибольшее содержание рецептора АСЕ2 наблюдается в эпителии легких, тонкого кишечника, почек и сердца. Высокая концентрация также была найдена в коре головного мозга и миндалевидном теле. Наиболее высокий уровень экспрессии АСЕ2 выявлялся в стволе головного мозга, то есть в мосте и, в частности, в продолговатом мозге, содержащем дыхательные центры. Точный полный механизм проникновения вируса неизвестен, но было выявлено интраназальное проникновение вируса на нервно-слизистой границе в обонятельный нерв, затем в различные области головного мозга и в ствол мозга. Также наблюдались случаи проникновения COVID-19 по оси легкие-блуждающий нерв. Известно, что вирусное поражение продолговатого мозга, в котором находится дыхательный центр, может вызывать его дисфункцию, что приводит к стойким нарушениям функции контроля дыхания, а литературные данные свидетельствуют о высокой степени поражения ствола мозга у пациентов с дыхательной недостаточностью. Преимущественно механизмом этих патологий является вызванная вирусом иммунная реакция. Можно отметить, что дыхательная недостаточность с летальным исходом развивается в результате прямой инвазии вируса COVID-19 в ствол мозга, что приводит к его дисфункции (рисунок) [12, с. 2-3; 13, с. 3; 14, с. 286-287].
Другим фактором является механическое повреждение, к наиболее частому примеру которого можно отнести черепно-мозговую травму. Осложнения возникают быстрее и чаще при тяжелой форме. Таковыми являются острое повреждение легких, острый респираторный дистресс-синдром, пневмонии и нейрогенный отек легких. Конкретно к дыхательному центру имеет отношение. При нейрофизиологических исследованиях у пострадавших острым респираторным дистресс-синдромом выявлялось нарушение функция стволовых структур головного мозга на уровне моста и головного мозга при I степени с субкомпенсацией, при II с декомпенсацией. Существует несколько причин развития ОРДС у пациентов с ЧМТ. Наиболее важными из них, безусловно, являются нейрогенный отек легких, вызванный высвобождением катехоламинов после повреждения ствола головного мозга, и системная воспалительная реакция, связанная с любой тяжелой травмой, включая двустороннюю внутрибольничную пневмонию, которая не редкость у таких пациентов [15, с. 2].
Механизм возникновения острого респираторного дистресс-синдрома многофакторный. Тяжелая черепно-мозговая травма вызывает увеличение внутричерепного давления, которая ведет к ишемии и гипоксии головного мозга. Эти процессы ведут к активации рецепторов давления, расположенных в гипоталамусе, стволе и спинном мозге. При поражении, вызывающем повышенную реакцию соответствующих структур, превышающем возможности компенсации сосудистой системы легких, наблюдается интерстициальный отек и кровоизлияния в перивазальное пространство. При развитии воспалительной реакции на травму, происходит утяжеление ДВС-синдрома вследствие дислокации головного мозга, что ведет к дополнительным нарушениям функции ствола мозга, в том числе и дыхательных центров, из-за сдавления и нарушения местоположения (рисунок) [16, с. 5; 17, с. 608].
При экспериментах, моделирующих бульбо-спинальные повреждения, которые часто встречаются при черепно-мозговой и спинномозговой травмах, была выявлены некоторые особенности функционирования. При массивном подобном повреждении, отсекающем верхние отделы от нижних, происходит прерывание проводящих путей, этом обычно дистальные отделы в дальнейшем отмирают. Было исследовано явление регенерации кортикоспинальных нейронов, связанное со специфической регуляцией генов, связанных с ростом. Она может происходить при внутримозговых, но не спинномозговых поражениях. Таким образом, может происходить восстановление функций дыхательного центра и соответствующих путей после механического повреждения, если не были повреждены аксоны в месте перехода продолговатого мозга в спинной. Также нейропластичность может приводить к формированию спинальных генераторов дыхательного ритма при массивных нарушениях основного генератора в продолговатом мозге [18, с. 8].
Среди причин возникновения патологических типов дыхания можно назвать химическое поражение или отравление. В работе Широлапова И.В. и Тихомирова Л.Н., показано, что продолговатый мозг чувствителен к химическим факторам. Были проведены исследования, показавшие, что оксибутират в высоких дозах может вызвать нарушение центральной регуляции дыхания, в том числе нарушение в работе основного генератора дыхательного ритма, приводя к развитию апнейстического дыхания. В низких дозах оксибутират повышает резистентность организма к различным формам кислородной недостаточности, в том числе и к локальной гипоксии. Но в высокой концентрации он сдвигает баланс про – и антиоксидантных систем преимущественно в нервной системе, в частности головном мозге. В этом случае наблюдается уменьшение устойчивости к свободнорадикальному окислению, в результате чего появляется патологическое дыхание. Было выявлено, что причинами подобного типа дыхания не являются нарушение гемодинамики и снижение напряжение кислорода в крови. Был сделан вывод, что оксибутират оказывает тормозящее действие как медиатор и модулятор (рисунок) [19, с. 2-4; 20, с. 25].
Также одним из примеров химического поражения дыхательного центра является взаимодействие его клеток с повышенным содержанием в крови углекислого газа, которое возникает при его соответственно повышенном содержании в окружающем воздухе. Концентрация, равная 2,9% в исследовании выявленная как пограничная, вызывает функциональные сдвиги в организме, в том числе нарастание глубины дыхания. При концентрации, близкой к 3%, у человека происходит повышение чувствительности дыхательного центра. При более высоких может происходить декомпенсация и формирование патологических форм дыхания в результате гипоксии дыхательного центра, высокочувствительного к этому фактору [21, с. 3; 22, с. 947].
Вывод
Таким образом, проведя анализ литературных данных, можно сделать вывод о том, что под воздействием множества факторов, вызванных различными эндогенными и экзогенными причинами, дыхательный центр может изменять свою деятельность в зависимости от типа и силы воздействия, претерпевая адаптивные или деструктивные изменения.

