Арктический бассейн является уникальным регионом со своеобразными природными условиями и живыми организмами. Наличие ледового покрова и полярной ночи значительно ограничивают период, благоприятный для первичного продуцирования органического вещества гидробионтами и развития трофических сетей. Наземные и морские экосистемы развиваются в экстремальных условиях, отличающихся низкими температурами среды и видовым разнообразием. В результате морские экосистемы здесь наиболее чувствительны и уязвимы к любому внешнему воздействию [1]. Именно поэтому в арктических экосистемах существует необходимость совершенствования и развития системы диагностического и прогностического мониторинга водных объектов для получения количественных показателей, характеризующих специфику, источник, степень и масштаб воздействия, и ответную реакцию отдельных организмов и природных экосистем в целом на оказанные воздействия [2]. Эксперименты по влиянию загрязняющих веществ на морские организмы являются одними из ключевых составляющих биомониторинга и оценки последствий попадания этих веществ в окружающую среду. Таким образом, совершенствование стандартов и разработка новых методик для биомониторинга экологически значимых видов является важной проблемой экотоксикологии [3].
Наиболее репрезентативным объектом (биологической мишенью) токсических экспериментов был выбран зоопланктон, а именно – веслоногие ракообразные (лат., Copepoda). Оценка воздействия на копепод представляет большой научный интерес, поскольку они играют значительную роль в водных экосистемах и экологии в целом. Эти организмы имею наибольшую биомассу среди всех гидробионтов и занимают первое место в доле производства вторичной продукции водоемов. Также, копеподы занимают важное место в трофической цепи – они являются консументами первого порядка в водных экосистемах и основными потребителями фитопланктона с одной стороны, а с другой стороны служат основной пищей для других гидробионтов [4].
В русскоязычной литературе практически не встречается работ по токсикологическому воздействию на биологические или экологические мишени в данном регионе и на арктические экосистемы в целом. Однако, в англоязычной литературе токсические эксперименты с копеподами получили широкое распространение [5,6,7].
Материалы и методы исследования
Объектом исследования при проведении экспериментов стала бентосная копепода из отряда гарпактикоидов – Nitocra lacustris. Все эксперименты были выполнены на базе лаборатории полярных исследований им. О.Ю. Шмидта Арктического и Антарктического научно-исследовательского института (ААНИИ).
На данном этапе первым автором разработана методика проведения токсикологических экспериментов по внешнему воздействию на копепод. Проведение одного лабораторного эксперимента занимает достаточно большое количество времени и состоит из нескольких этапов (таблица).
После начальных приготовлений следует этап отбора самок с яйцевидными мешками в специальные контейнеры, где они будут находиться все время эксперимента. Один контейнер представлен 6 чашками Петри, в каждой из которых содержится по 3 самки с яйцевидными мешками. Количество контейнеров определяется целями эксперимента (например, сколько различных концентраций токсиканта следует рассмотреть). Кроме этого, всегда должен быть один контейнер с контрольной группой, на которую не будет оказано воздействие токсического вещества.
Методика проведения токсикологического эксперимента с копеподами
|
№, п\п |
Название этапа |
Время выполнения |
Необходимое оборудование |
|
1 |
Проверка копепод на наличие достаточного кол-ва самок |
1 день |
Бинокуляр |
|
2 |
Подготовка пищи в виде диатомовых водорослей |
1-2 недели |
Лабораторная посуда, микроскоп, магнитная мешалка, дозаторы, морская вода (или её эквивалент) |
|
3 |
Отбор самок в контейнеры |
1-2 дня |
Контейнеры с ячейками, дозаторы, бинокуляр |
|
4 |
Подготовка раствора токсиканта, и добавление необходимой концентрации в контейнеры |
1 час |
Лабораторная посуда (емкости для раствора), токсикант, дозаторы |
|
5 |
Наблюдение за копеподами (подсчет науплиусов и копеподитов) |
От нескольких дней до нескольких месяцев или больше |
Бинокуляр |
|
6 |
Обработка и визуализация результатов |
2-3 дня |
Компьютер и необходимое ПО |
В данной серии экспериментов было необходимо изучить оценку воздействия пестицидов на арктическую экосистему. В качестве токсиканта был выбран дихлофос, поскольку в его составе содержится циперметрин – соединение, широко применяющееся в инсектицидах в аквакультуре для борьбы с рыбными паразитами, тем самым попадая в окружающую водную среду. Таким образом, важно проследить его токсическое воздействие на низшие уровни трофической цепи.
Следующий этап – наблюдение за развитием копепод. Время этого этапа зависит от целей исследований. В данной работе основная задача экспериментов – проследить, смогут ли самки Nitocra при определенной концентрации токсиканта дать потомство, которое доживет до стадии самок и само сможет произвести уже следующее поколение копепод.
Наблюдение за копеподами производилось раз в 2 дня под бинокуляром и заключалось в следующем:
• Осмотре состояния самок;
• Подсчете количества науплиусов (планктонная личинка копепод);
• Подсчете количества копеподитов (переходная стадия от личинки к взрослой особи);
• Регистрации температуры воды в день наблюдения с помощью термометра;
• Записи результатов наблюдения в лабораторный журнал.
Результаты исследования и их обсуждение
Традиционно при исследовании загрязнения водной среды нормальное её функционирование возможно лишь при непревышении т.н. ПДЭН (предельно допустимой экологической нагрузки). В качестве ПДЭН рекомендуется выбирать биологически допустимый (толерантный) для гидробионтов диапазон концентраций токсикантов в воде, в пределах которого организмы, их сообщества и популяции располагают возможностями оптимальной реализации своих физиологических, экологических и других функций. Критическими считаются такие концентрации загрязняющих веществ (ЗВ), при которых даже небольшое дополнительное воздействие может привести к необратимому изменению биологического процесса, выбранного в качестве экологической "мишени". Токсичной (ингибирующей) концентрацией считается такая концентрация токсиканта, при которой относительные (по сравнению с контролем) значения роста (плодовитости, скорости деления, фотосинтеза и др.) достоверно снижаются более чем на 50 % от соответствующих показателей в контрольном варианте в опытах длительностью не менее 2-4 суток. К пороговым относятся концентрации, которые изменяют аналогичные показатели в пределах до 50 %, в т.н. хронических опытах, длительность которых соизмерима с продолжительностью жизненного цикла. Максимально недействующей (подпороговой) концентрацией (МНК) принимается такая концентрация, при которой основные показатели жизнедеятельности организмов в хронических опытах отклоняются не более чем на 25 % от контроля [8,9].
Следуя существующим рекомендациям, было проведено 3 токсикологических лабораторных эксперимента. Первый эксперимент был начат 29 сентября 2022 года, в этот день самки копепод были пересажены в экспериментальные контейнеры. На 6 день (4 октября) был добавлен токсикант. Начальные концентрации токсиканта составляли 0.1 мг/л, 0.5 мг/л и 1 мг/л соответственно.
По итогам этого и последующих экспериментов результаты каждой исследуемой группы визуализировались с помощью диаграммы «ящик с усами» (набор данных о численности науплиусов в группе был осреднен по каждой чашке Петри в контейнере).
Таким образом, до добавления токсиканта все группы развивались в нормальном состоянии, однако после воздействия на них жизнедеятельность самок и уже родившихся науплиусов снизилась до нуля. Они все еще подавали признаки жизни (двигали сегментами тела), но были парализованы и вероятно, не могли питаться. Стоит отметить, что в контейнерах с токсикантом было замечено много родившихся науплиусов, однако они все быстро погибали.
В итоге, во всех трех контейнерах в эксперименте с нагрузкой все особи погибли через неделю после добавления токсиканта (11 октября). Контрольная группа продолжала активно развиваться.
Второй эксперимент был проведен с уменьшением концентраций токсиканта в 10 раз. Первый день эксперимента – 1.12.2022. Токсикант был добавлен на второй день (2.12.2022). Экспериментальных контейнеров было уже 3 – контрольная группа и 2 группы с концентрацией токсиканта 0.05 мг/л и 0.01 мг/л соответственно. Результаты представлены ниже (рис. 2).
Как видно из рисунка 2, численность науплиусов в контейнерах начала сильно снижаться к концу эксперимента. Впоследствии все особи, включая самок, погибли. Они также были парализованы и не могли продолжать свою жизнедеятельность.
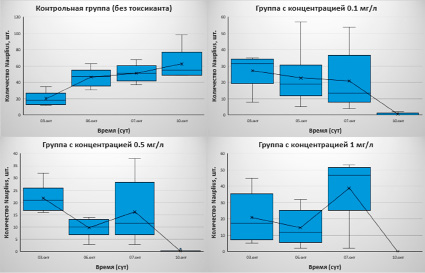
Рис. 1. Результаты первого эксперимента (29.09.22-11.10.22). Подсчет науплиусов в каждом из контейнеров на основе диаграммы «ящик с усами». Синий прямоугольник – квартильный размах; вертикальные линии – значения минимума и максимума; крест, соединенный линией – среднее значение численности особей
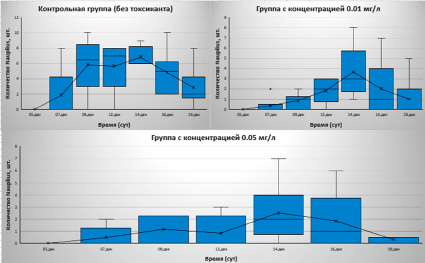
Рис. 2. Результаты второго эксперимента (1.12.2022-19.12.2022). Подсчет науплиусов в каждом из контейнеров на основе диаграммы «ящик с усами». Синий прямоугольник – квартильный размах; вертикальные линии – значения минимума и максимума; крест, соединенный линией – среднее значение численности особей
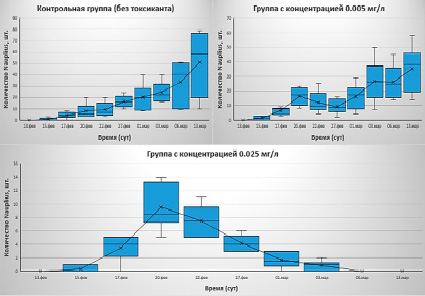
Рис. 3. Результаты третьего эксперимента (13.02.2023-13.03.2023). Подсчет науплиусов в каждом из контейнеров на основе диаграммы «ящик с усами». Синий прямоугольник – квартильный размах; вертикальные линии – значения минимума и максимума; крест, соединенный линией – среднее значение численности особей
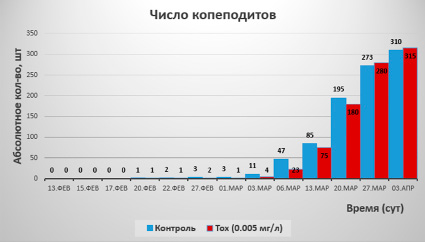
Рис. 4. Количество копеподитов в контрольной группе (синие столбцы) и в группе с концентрацией токсиканта 0.005 мг/л (красные столбцы)
Для третьего эксперимента концентрации токсиканта были снижены в два раза по сравнению со вторым экспериментом и составили 0.025 мг/л и 0.005 мг/л соответственно. Первый день эксперимента – 13.02.2023. Токсикант был добавлен на третий день (15.02.2023). Результаты самого эксперимента представлены ниже (рис. 3).
Третий эксперимент принес наиболее значимые результаты. Из рисунка видно, что группа с концентрацией 0.025 мг/л вся погибла. В тоже время контрольная группа и группа с наименьшей нагрузкой продолжали активно развиваться. Эксперимент продлился более месяца, однако подсчет науплиусов был остановлен 13 марта, так как дальнейший подсчет не представлялся возможным из-за значительного количества родившихся личинок.
На рисунке 3Б видно, что с 20 по 27 февраля происходило снижение количества науплиусов, вероятно связанное с влиянием токсиканта. В целом по визуальным наблюдениям была замечена более низкая активность в группе с нагрузкой в первой половине эксперимента. Однако, самки уже не были парализованы и могли нормально перемещаться, питаться и производить потомство. Были также замечены смерти науплиусов (около 30% от общего количества) в первой половине эксперимента.
Также в ходе третьего эксперимента особи доросли до стадий копеподит (рис. 4), а затем некоторые из них до стадий самок и также смогли производить потомство.
Из диаграммы видно, что к началу появления копеподитов, их количество в контрольной группе было в 2 раза больше (3.03 и 6.03). К концу эксперимента их число выровнялось, что скорее всего может быть связано с улетучиванием токсиканта из воды.
Заключение
В результате исследования разработана методика по подготовке и проведению лабораторного токсикологического эксперимента с биологической мишенью, распространенной в арктических экосистемах. Выполнена серия из трех экспериментов с колонией копепод Nitocra lacustris. На основе статистического анализа полученных результатов было оценено влияние дихлофоса на зоопланктон и выявлены критические концентрации токсиканта в воде. При концентрации 0.01 мг/л и выше все особи без исключения погибали, при этом чем выше концентрация, тем процесс гибели наступал быстрее. При концентрации 0.005 мг/л было замечено некоторое влияние на копепод, однако колония продолжала активно развиваться – личинки достигли половозрелой стадии и смогли сами производить потомство. Эта концентрация отнесена нами к эффективной концентрации (EC), при которой организмы начинают реагировать на наличие токсиканта в воде.
Следующими этапами работы будет выявление критических концентраций токсиканта, рекомендованных для получения токсичных, пороговых, максимально недействующих (подпороговых) концентраций токсикантов с дополнительным учетом рисков попадания загрязняющих веществ в водную среду. Оценка влияния токсиканта на экосистему в целом будет выполняться с привлечением возможностей имитационного моделирования водных экосистем (модель AQUATOX) и концентраций токсикантов, определенных в экспериментах с Nitocra lacustris.

