На протяжении десятилетий проводились научные дискуссии об использовании антиоксидантов для лечения рака человека, но, чтобы сделать какой-либо вывод, количества проведенных исследований недостаточно. Изучение свойств эфирных масел в модельных системах и на живых организмах представляет значительный научно–практический интерес, который может позволить выявить связи между составом масел и их антиоксидантными свойствами, изучить возможные биохимические механизмы действия.
В настоящее время для лечения различных видов рака широко используются (по отдельности и в сочетании) три вида терапии: химиотерапия, лучевая терапия и иммунотерапия. Одним из последствий химиотерапии и лучевой терапии является генерация реактивных форм кислорода (ROS), которые посредством прямого и косвенного воздействия на опухолевые клетки индуцируют повреждение ДНК и влияют на механизмы репликации ДНК, что приводит к отклонениям в сигнальных путях [1]. Большинство из этих методов не считается эффективным вариантом лечения рака в прогрессирующей стадии с метастазами, что возможно связано с приобретением резистентности к опухоли и развитием локальной токсичности, приводящим к уменьшению чувствительности или рецидиву заболевания. Следовательно, потенциально новые терапевтические подходы и агенты, проявляющие антиканцерогенные свойства, потенцирующие апоптоз опухолевых клеток необходимы для продления жизни больных с онкопатологией [2].
Из данных литературы известно об альтернативном лечении онкологических больных с использованием ароматерапии эфирными маслами растений.
Эфирные масла растений представлены преимущественно веществами изопреновой природы, терпеноидами, многокомпонентными системами. Основными их компонентами являются монотерпеновые спирты и их сложные эфиры, к которым относятся линалоол и линалилацетат. Так в эфирном масле лаванды на линалилацетат приходится до 17 % и на линалоол – до 61 % . В эфирном масле шалфея мускатного, напротив, больше линалилацетата (до 63 %), а линалоола – до 23 % [3].
Показано преимущество применения ароматерапии в комплексе с лекарственной терапией. Это основано на том, что у пациентов происходит снижение уровня тревоги, эмоционального стресса, боли, мышечного напряжения, усталости, что способствует достижению положительных результатов проводимого лечения [4].
Экспериментально доказано антиканцерогенное действие эфирного масла лаванды и его основных компонентов, которое проявлялось в ингибировании пролиферации клеточных линий рака простаты человека PC-3 и DU145 и индукции апоптоза в опухолевых клетках [5].
Цель исследования: оценить возможность использования терапии природными антиоксидантами (эфирные масла лаванды настоящей, шалфея мускатного и эвкалипта шаровидного) при экспериментальной миеломе на линейных мышах.
Материалы и методы исследования
Исследование проводили на линейных 3-х месячных мышах – самцах BALB/c (n = 36), у которых моделировали миеломную болезнь путем внутрибрюшинного введения клеток Sp 2/0 Ag14 из расчета 106 клеток на мышь. В качестве антиоксидантной терапии применяли ингаляционное введение эфирных масел (ИЭМ): эвкалипта шаровидного (Eucalyptus globules), лаванды настоящей (Lavandula vera) и шалфея мускатного (Salvia sclarеa), полученных из Крыма (Научно-производственная фирма «Царство ароматов», г. Судак), по результатам предыдущих исследований, обладающих не только иммунокорригирурующими и антиоксидантными свойствами, но и антиканцерогенными [6].
Проводили ИЭМ, начиная со второго дня после внутрибрюшинной инъекции миеломных клеток. Метод ИЭМ представлял собой аэрофитотерапию эфирными маслами в парах воды около 80 °С до примерной концентрации в воздухе 4-5 мг/м3. Терапия длилась две недели, по 45 минут в день.
Исследование противоопухолевых свойств эфирных масел проводили по таким показателям, как торможение прироста массы тела (ТПМ), торможение развития асцита (ТРА), средняя продолжительность жизни или медиана (МПЖ), а также по показателю увеличения продолжительности жизни (УПЖ).
Животных разделяли на три группы: 1 – контроль (мыши с индуцированной миеломой); 2 – «миелома + ИЭМ1» (смесь эфирных масел лаванды настоящей и шалфея мускатного в соотношении 2:1) и 3 – «миелома + ИЭМ2» (эфирное масло эвкалипта шаровидного). Во 2 и 3 группах животным с привитой миеломой одновременно проводили ИЭМ. Асцит у мышей развивался к концу первой недели. Показатели противоопухолевой активности оценивали на 16-е сутки от начала эксперимента.
Величину ТПМ определяли, используя формулу:
ТПМ = [(∆к-∆о)/∆к] ∙100 %,
где ∆к – прирост массы тела в группе «контроль», г
∆о – прирост массы тела в группе «опыт», г
ТРА рассчитывали по следующей формуле:
ТРА = [(АЖк-АЖо)/АЖк] ∙100 %,
где АЖк – количество асцитической жидкости в группе «контроль», мл
АЖо – количество асцитической жидкости в группе «опыт», мл
УПЖ определяли, используя формулу:
УПЖ = [(МПЖо – МПЖк)/МПЖк]∙100 %,
где МПЖк – средняя продолжительность жизни в группе «контроль» (дни);
МПЖо – средняя продолжительность жизни в группе «опыт» (дни).
При оценке значений МПЖ за 100 % принимали средний показатель в группе животных после применения ИЭМ1.
Для сравнения данных эксперимента проводили анализ зарубежной и отечественной литературы о возможности применения эфирных масел растений или их компонентов в противоопухолевой терапии.
Результаты были обсчитаны с использованием статистической программы STATISTICA 10.0.
Результаты исследования и их обсуждение
Результаты данного исследования представлены в таблице (таблица).
Если принять за 100 % прирост массы тела мышей контрольной группы без лечения, то видно, что у животных, получавших терапию ИЭМ1 прирост массы тела снизился на 52,3 %, а после применения ИЭМ2 – на 43,4 %. Наибольшее значение ТРА наблюдалось у животных после применения ИЭМ1 и составляло 54,3 %, что на 6,8 % выше по сравнению с группой животных, получавших ИЭМ2.
Использование эфирных масел вызывало увеличение МПЖ на 71,4 % после ИЭМ1 и 58,5 % – после ИЭМ2. Возрастал при этом также и показатель УПЖ: после ИЭМ1 на 289,5 %, после ИЭМ2 – на 237,3 % (рисунок). Оставшиеся в живых подопытные животных были здоровы и активны в течение полугода наблюдений.
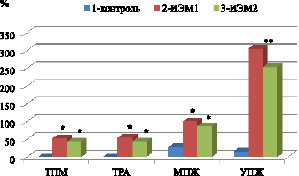
Оценка противоопухолевой активности терапии с использованием ингаляционного введения эфирных масел (ИЭМ) у лабораторных мышей линии BALB/c с индуцированной миеломой Sp 2/0 Ag14 по показателям противоопухолевой активности: ТПМ – торможение прироста массы тела, ТРА – торможение развития асцита, МПЖ – медиана продолжительности жизни, УПЖ – увеличение продолжительности жизни в группах животных: 1 – контроль без лечения, 2 – после применения ИЭМ1, 3 – после применения ИЭМ2. Примечание. * – отличия статистически значимы по сравнению с группой «контроль», ** – отличия статистически значимы по сравнению с группами 1 и между 2 и 3 (р < 0,05)
Из литературных данных известно, что антиоксиданты оказывают влияние на распределение клеток по фазам клеточного цикла, что в перспективе может позволить разработать методы таргетной терапии и диагностики онкологических заболеваний. Прооксиданты, к которым относятся АФК, продуцируемые в различных метаболических реакциях, происходящих, главным образом, в митохондриях, пероксисомах и эндоплазматическом ретикулуме, могут быть вовлечены в опухолегенез, прогрессирование опухоли и метастазирование [7]. Семейство ферментов НАДН-оксидаз, являющихся наиболее распространенными внутриклеточными источниками генерации АФК, имеют ведущее значение для облегчения перицеллюлярного протеолиза, что указывает на их роль в уменьшении метастазов [8]. Понимание роли АФК в пролиферации, прогрессировании и метастазировании опухолей может помочь в разработке комбинированных методов лечения.
Результаты нашего исследования согласуются с данными литературы. По [9] некоторые из компонентов эфирных масел (n-цимен, гамма-терпинен) оказывают ингибирующее действие на жизнеспособность раковых клеток без какого-либо значительного влияния на нормальные клетки, индуцируя апоптоз за счет генерации АФК, разрушения митохондриального мембранного потенциала, активации каспазы-3 и повреждения ДНК. Показано, что под действием эфирного масла из растения тысячелистника обыкновенного (Achillea millefolium) снижалась пролиферация раковых клеток HeLa (CCL-2) [10]. Исследование влияния антиоксиданта изомелавонового компонента генистеина сои на рак предстательной железы, показало, что как соя, так и генистеин ингибировали рост клеток рака предстательной железы человека PC-3 in vitro и ортотопических опухолей PC-3 in vivo, причем эти эффекты усиливались, их введение сочеталось с проведением лучевой терапии [11]. Обнаружено также, что природный антиоксидант куркумин оказывает подавляющее действие на апоптоз и ингибирование иммуносупрессии Т-клеток [12].
Основной функцией антиоксидантов является нейтрализация образующихся свободных радикалов и ингибирование повреждающих эффектов АФК. Показано, что при начальных стадиях рака достигается более значительный эффект антиоксидантной терапии [13].
Установлена глубокая, до конца не понятая связь между обонятельной и иммунной системами [14]. Можно проследить ее, опираясь на некоторые известные факты. Так проведение обонятельного стимула начинается с того, что пахучие вещества, в данном случае компоненты эфирных масел (ЭМ) взаимодействуют с рецептором мембраны обонятельной клетки. В результате этого происходит активация обонятельного рецептора, соединенного с G-белком (англ. G protein coupled receptor). Связывание ЭМ с рецептором приводит к актиации G-белка, который вызывает активацию аденилатциклазы, в результате которой от ГТФ отщепляется молекула фосфата и он превращается в ГДФ. Активированный фермент катализирует реакцию превращения АТФ в циклическую АМФ (цАМФ), которая взаимодействует с цАМФ-зависимым катионным каналом в мембране, что приводит к открытию потока ионов Na+ и Са2+ в обонятельную клетку, и запускает потенциал действия в этой клетке, что вызывает передачу сигнала на афферентные нейроны. В некоторых случаях обонятельные рецепторы активируют фосфолипазу, и тогда вторичными посредниками выступают инозитолтрифосфат и диацилглицерол. Возможно также, что в обонятельных клетках из-за активации ионами кальция NO-синтазы образуется оксид азота, вызывающий образование цГМФ. Т.е. мы видим, что действие эфирных масел можно сравнить с действием гормонов. Нервные импульсы запускают синтез клетками гипоталамуса нейропептидов, контролирующих выброс гормонов гипофиза, вызывающих, в свою очередь, синтез гормонов в периферических железах, оказывая влияние на все системы организма, в том числе, иммунную. Результатом может быть стимуляция фиксации активированных компонентов комплемента на опухолевых клетках, аккумуляция нейтрофилов и проявление их киллерного эффекта в отношении асцитных опухолевых клеток [15].
Заключение
Таким образом, полученные результаты свидетельствуют о том, что проведение терапии эфирными маслами Eucalyptus globulus и Lavandula vera в смеси с Salvia sclarеa замедляет развитие асцита у мышей с привитой миеломой Sp 2/0 Ag14, что выражалось в увеличении показателей торможения прироста массы тела и развития асцита. При этом также наблюдалось увеличение продолжительности жизни животных, в большей степени, после применения смеси эфирных масел лаванды и шалфея. После дальнейших исследований проведение такого вида терапии может быть рекомендовано для профилактики и повышения эффективности лечения онкологических заболеваний.

