Введение
Гестационный сахарный диабет (ГСД) – заболевание беременных женщин, которое характеризуется впервые выявленной гипергликемией и инсулинорезистентностью, но не соответствующее критериям сахарного диабета (СД). В настоящее время ГСД является серьезной проблемой, которая угрожает здоровью и жизни, как беременной женщины, так и плоду [1].
Цель исследования – изучение патофизиологических процессов, лежащих в основе развития ГСД, и влияние заболевания на организм беременной женщины и плода.
Материалы и методы исследования
Был проведён обзор и анализ литературы по выбранной теме за последние 34 года. При этом были использованы поисковая система «E-library», «Pubmed». Статьи, выбранные для рассмотрения и анализа содержали доказательную и клиническую базы по наиболее современным и актуальным данным.
Результаты исследования и их обсуждение
Впервые ГСД был описан Бенневицем в 1824 году в Германии, следующие случаи были зафиксированы в Соединенном Королевстве и США, где сообщалось о высокой смертности новорожденных у женщин с СД, который развивался во время беременности. До 1964 года ученые предполагали, что у женщин во время беременности развивается СД 2 типа. Однако, в 1909 году, Уильямс назвал данное заболевание – «транзиторная глюкозурия во время беременности». Он же изучил, лежащие в основе патологии, физиологические и патофизиологические механизмы развития [2].
Опираясь на статистические данные, ГСД в структуре эндокринных заболеваний, развивающихся во время беременности, занимает лидирующую позицию. Согласно данным исследования Международной диабетической федерации за 2021 год, распространенность данной патологии выросла с 2-4% до 7-22% [3], всего за 2021 год было зарегистрировано 21,1 млн (16,7%) случаев развития у беременных нарушений углеводного обмена, в том числе и ГСД, стоит отметить, что 1 из 6 новорожденных родился от матери, у которой во время беременности развился ГСД [4].
Большое значение в развитии ГСД имеет расовая принадлежность. Доказано, что распространенность ГСД в: Северной Африке – 15,2%, в Южной Африке – 10,8%, в Юго-Восточной Азии – 15%, в Южной и Центральной Америке – 11,2%, в России – 7%, в Европе – 6,1%, в странах Ближнего Востока – 15,7% (рис.1) [5].
Развитие ГСД в первом триместре беременности повышает вероятность самопроизвольного прерывания беременности, возникновения врожденных пороков мозговых структур, центральной нервной системы и сердца плода. При возникновении патологии на поздних сроках беременности у плода возможно развитие гиперинсулинемии, диабетической фетопатии и чрезмерный рост плода [6].
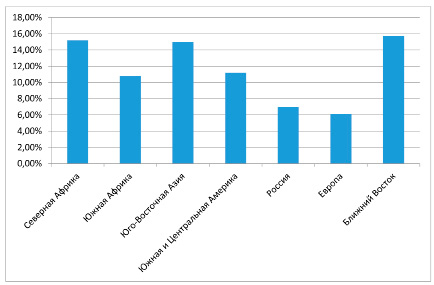
Рис. 1. Распространенность гестационного сахарного диабета
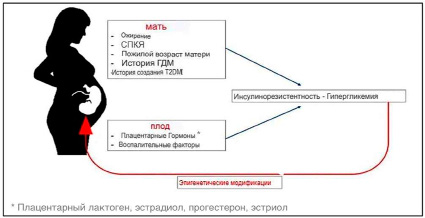
Рис. 2. Факторы риска развития гестационного сахарного диабета
У беременной женщины происходит развитие инсулинорезистентности, вследствие изменений в углеводном обмене, обусловленные секрецией гормонов. Фактором риска развития резистентности клеток к инсулину является увеличение веса во время или ещё до беременности. Ожирение обусловлено ускорением липолиза в организме женщины. Повышение уровня свободных жирных кислот, возникающее у матери усугубляет инсулинорезистентность за счет ингибирования поглощения глюкозы и стимуляции глюконеогенеза в печени (рис. 2) [7]. Повышенная инсулинорезистентность беременной женщины приводит к повышению уровня глюкозы после приема пищи и увеличению облегченной диффузии через плаценту, что приводит к большей доступности глюкозы для плода. Рост инсулинорезистентности приводит к тому, что тестирование на ГСД откладывается, обычно инсулинорезистентность приходится на середину второго и конец третьего триместра беременности [2].
При ожирении развивается инсулинорезистентность, в результате уменьшения количества рецепторов на поверхности клеток к инсулину. Это приводит к снижению эффектов инсулина. Происходит увеличение адипоцита в объеме, в связи с чем и уменьшается число рецепторов и снижение чувствительности жировой ткани к действию инсулина. Повышенный уровень секреции и пролиферации инсулина бета-клетками поджелудочной железы регулируется плацентарными гормонами, которые выделяются для роста плода. Снижение усвоения глюкозы, усиление глюконеогенеза в печени и гипергликемия во время беременности возникают вследствие роста резистентности мышечных и жировых клеток к инсулину, что приводит к развитию ГСД [8]. Данное патологическое состояние проявляется декомпенсацией бета-клеток поджелудочной железы, что приводит к снижению секреции инсулина [9]. Этот процесс сопровождается развитием гиперлипидемии, в результате развивается липотоксическое повреждение бета-клеток поджелудочной железы, а это ещё больше снижает выработку инсулина. Также снижение усвоения глюкозы, глюконеогенеза и гипергликемия могут развиваться в результате недостаточной гиперплазии бета-клеток поджелудочной железы [9, 10].
Увеличение инкретинов сопровождается стимуляцией секреции инсулина бета-клетками поджелудочной железы. К инкретинам, которые оказывают такое влияние, относятся гастроингибирующий пептид и глюкогоноподобный пептид-1. ГСД развивается при ненормальной секреции инкретинов. Их секреция увеличивается в результате активации компенсаторных процессов, которые направлены на противодействие резистентности к глюкогоноподобному пептиду-1 [11]. В норме, инкретины вырабатываются в ответ на поступление глюкозы и стимулируют работу бета-клеток поджелудочной железы. Эти вещества предотвращают чрезмерный рост плода, и обеспечивают компенсаторные функции организма [12].
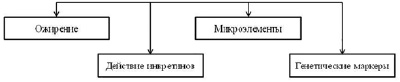
Рис. 3. Причины развития гестационного сахарного диабета
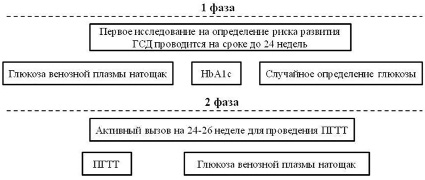
Рис. 4. Диагностика нарушений углеводного обмена во время беременности
Выявлены генетические маркёры, в присутствии которых риск развития ГСД возрастает в несколько раз. К таким маркёрам относятся: гены, связанные с нарушением секреции инсулина – ген транскрипционного фактора 7, субъединица-1 циклинзависимой киназы типа 5, ген MT-DN1 [13]. Данные гены кодируют рецептор бета-катенина, который отвечает за регуляцию секреции проглюкагона. Функцией данного белка является регуляция созревания бета-клеток поджелудочной железы, а также секреция гранул инсулина в кровоток (рис. 3) [14].
Гены, регулирующие липидный обмен – ген, ассоциированный с жировой массой и ожирение; ген-энхансер белка трансдуцина; ген, регулирующий активность глюкозо-6-фосфатазы. Эти гены находятся в эпителии тонкой кишки, с их помощью происходит всасывание жиров. Помимо этого, гены ответственны за регуляцию потребления энергии, подавление липолиза [15]. Гены, связанные с дефектом действия инсулина и нарушением инсулинового сигнала – ген субстрата инсулинового рецептора СИР-1. Данный ген связан с дефектом действия инсулина и нарушением проведения инсулинового сигнала [16].
Основными микроэлементами, влияющими на развитие ГСД, являются магний и железо, витамин Д. С дефицитом магния связано развитие ожирения у беременных женщин. Механизмом развития является нарушение регуляции метаболизма глюкозы и инсулина, что влияет на активность тирозинкиназы рецептора инсулина, который регулирует транспорт глюкозы. В свою очередь дефицит железа стимулирует выработку воспалительных цитокинов, которые увеличивают инсулинорезистентность клеток. Недостаток витамина Д снижает секрецию инсулина, негативно влияет на липидный профиль, уровень глюкозы и С-пептида [17].
Во время беременности количество глюкозы крови должно находиться на более низком уровне в сравнении с не беременными женщинами. Такой уровень глюкозы поддерживается повышенной секрецией инсулина. Этот процесс направлен на адаптацию организма к своему новому состоянию. Количество секретируемого инсулина по сравнению с нормой увеличивается на 200-250%, только в этом случае уровень глюкозы остается в пределах нормы [18].
ГСД может проявляться клинически уже в первом триместре беременности, имитируя токсикоз. Пациентки могут жаловаться на ксеростомию, полидипсию, полиурию, изменения аппетита (как повышение, так и снижение), астению, кожный зуд, особенно в области промежности, увеличение массы тела, бессонницу. Также женщины отмечают учащение гнойничковых поражений кожи и фурункулёз. Если у женщины углеводный обмен был нарушен ещё до наступления беременности, то часто развиваются нарушения зрения, отёки нижних конечностей, снижение чувствительности нижних конечностей [19].
При постановке диагноза ГСД основные лечебные мероприятия направлены на модификацию образа жизни, а именно диетотерапия с полным исключением легко усваиваемых углеводов и ограничением жиров, а также физическая активность, интенсивность которой определяется сроком беременности. Необходим постоянный контроль уровня глюкозы в крови (рис. 4) [19].
Применение инсулина показано только при неэффективности диетотерапии и физических нагрузок в отношении нормализации уровня глюкозы в крови [9].
После родов, у женщин, которым был поставлен диагноз ГСД, проводится мониторинг уровня глюкозы в крови. Если цифры гликемии в норме, то рекомендуется проводить мониторинг 1 раз в год, при повышенном значении – исследование проводится каждые 3 месяца с дальнейшей консультацией специалиста. Также постоянному контролю подвергаются дети, мать которых во время родов перенесла ГСД [1].
Заключение
На основании вышеизложенного можно сделать вывод, что патогенез развития ГСД разнообразен и сложен. Активные методы профилактики, лечения и ранней диагностики могут быть разработаны на основании тщательных исследований молекулярно-генетических и эпигенетических механизмов развития нарушений углеводного обмена.
Библиографическая ссылка
Киселева А.Г., Ануфриева Е.И., Макеева А.В. ПАТОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ ГЕСТАЦИОННОГО САХАРНОГО ДИАБЕТА // European Journal of Natural History. 2025. № 1. С. 10-14;URL: https://world-science.ru/ru/article/view?id=34410 (дата обращения: 27.02.2026).

