Введение
В настоящее время трансплантология является одной из наиболее перспективных отраслей медицины, позволяющей добиться успехов в лечении многих заболеваний. Эта область медицины постоянно развивается благодаря достижениям как в медицинской, так и в хирургической сферах. Одними из наиболее часто трансплантируемых органов являются почки. Трансплантация почки (ТП) – лучший способ лечения терминальной стадии почечной недостаточности. По данным регистра Российского трансплантологического общества в 2023 г. в России было выполнено 3057 трансплантаций органов (рис. 1) [1]. По сравнению с 2018 годом количество трансплантаций выросло на 25% [2].
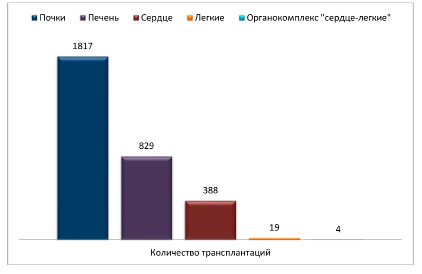
Рис. 1. Количество трансплантируемых органов за 2023 год
В настоящее время выживаемость людей, которые перенесли пересадку почки, спустя год после операции составляет около 96%. Однако развитие осложнений существенно влияет на функционирование пересаженного органа и качество жизни реципиентов. По частоте возникновения осложнений ведущим является отторжение почечного трансплантата. Несмотря на то, что на рынке появляются новые модифицированные имунносупрессивные препараты, вероятность возникновения осложнений после трансплантации, которые проявляются в отдаленном периоде остается высокой [3]. На фоне приема препаратов, подавляющих иммунитет зачастую присоединяются различные инфекции. Грамотрицательная флора несколько преобладает над грамположительной. При этом чаще всего обнаруживаются на бактериологическом посеве Enterococcus spp и E. coli [4].
В 2018 году Zhang J. и соавт. показали, что по прошествии шести месяцев после трансплантации в отношении инфекционных заболеваний пациенты делятся на три категории. В первой группе пациенты переводятся на длительную иммуносупрессивную терапию с минимальными дозами при хорошей функции аллотрансплантата. Во второй группе пациенты имеют хронические или прогрессирующие инфекции. Особую роль отводят иммуномодулирующим вирусам, например, цитомегаловирус, HCV, HBV, вирус Эпштейна-Барра. Они способствуют нарушению экспрессии медиаторов воспаления, что приводит к сенсибилизации организма к оппортунистическим инфекциям [5]. Среди пациентов третьей группы необходимо введение иммуносупрессоров в прежних высоких дозах, так как у них возникают повторяющиеся кризы отторжения (хроническое отторжение) – это приводит к хронизации вирусных инфекций.
Развитие онкологических заболеваний характерно примерно для 5% случаев и вероятность их возникновения пропорциональна дозе препаратов, угнетающих иммунитет, а также длительности их применения [6].
Несмотря на то, что достижения в области иммуносупрессивных препаратов и протоколов лечения значительно снизили частоту и серьёзность отторжения, на исход трансплантации почки по-прежнему существенно влияет развитие хронического клеточного или гуморального отторжения.
Целью данного исследования является изучение механизмов, лежащих в основе отторжения для минимизации вероятности возникновения осложнений и возможности их предупреждения.
Материалы и методы исследования
По данной теме был проведен анализ обзорной литературы, в том числе из баз данных Web of Science, PubMed, eLibrary.
Результаты исследования и их обсуждение
ТП представляет собой хирургическую операцию, которая состоит в пересадке почки от донора реципиенту. Такой вид оперативного вмешательства используется в качестве метода заместительной терапии при терминальной стадии хронической болезни почек (ХБП) [2,7]. Сейчас ТП считается «золотым стандартом» в лечении пациентов с ХБП [8, 9]. Необходимо упомянуть, что ИМТ>30 кг/м2, курение, артериальная гипертензия, системная красная волчанка, антифосфолипидный синдром, болезнь Бехтерева, ревматоидный артрит могут повышать риск отторжения и обеспечивать замедление функции трансплантата [10, 11]. Реакция отторжения пересаженных тканей или органов обычно возникает на 7-10-е сутки. При этом время, в течение которого трансплантат не будет вызывать этой реакции, зависит от его типа. Самым оптимальным будет являться аутотрансплантат (в этом случае донор и реципиент – один человек) и изотрансплантат (донор будет являться близнецом реципиента). Реакция отторжения при пересадке аллотрансплантата (донор и реципиент отличаются генетически и иммунологически) и ксенотрансплантата (донор и реципиент принадлежат к разным биологическим видам) будет протекать значительно быстрее [8]. По отношению к трансплантации почки применяется только изо- и аллотрансплантация. Но даже тщательный подбор донора органа не исключает вероятность возникновения осложнений.
Все осложнения, возникающие после трансплантации органа, можно разделить на 2 группы (хирургические и нехирургические). Среди хирургических осложнений выделяют сосудистые, урологические и раневые [12-14]. Зачастую причинами их развития служат ошибки в действиях врача или исходно сниженная резистентность организма к инфекциям. Основные нехирургические осложнения связанны с иммунологической реакцией и ведут к отторжению трансплантата, а из-за применения иммуносупрессивных препаратов резко возрастает количество инфекционных осложнений и возникают предпосылки для развития онкологических процессов [15].
Существуют два эффекторных механизма развития реакций отторжения. Первый будет носить название «хозяин против трансплантата». В этом случае, если организм способен реализовать иммунный ответ, то он распознает чужеродные антигены и приводит к отторжению трансплантата. Второй механизм будет работать, если у пациента имеются дефекты иммунной системы. Тогда пересаженные лимфоциты будут обеспечивать реакцию, заключающуюся в распознавании антигенов тканей реципиента. Чаще встречается первый механизм, в результате которого будут повреждаться клетки трансплантата [16, 17]. Также можно выделить врожденный и адаптивный иммунитет в качестве форм иммунного ответа на чужеродные патогены. Их различие состоит в том, что в формировании врожденного иммунитета принимают участие NK-киллеры, макрофаги, нейтрофилы, цитокины и система комплимента, которые обеспечивают неспецифический иммунитет и не формируют долговременную память об антигене [18]. В- и Т-лимфоциты участвуют в основном в развитии адаптивного иммунитета, при формировании которого организм запоминает и распознает антигены. Это приводит к возникновению устойчивых иммунных реакций при повторном воздействии одних и тех же антигенов.
На данный момент принято считать, что при появлении аллоантигена появляется основная клетка, свидетельствующая о развивающемся иммунном ответе – зрелый девственный CD4+ Т-лимфоцит. Она будет взаимодействовать с иммунокомпетентными клетками (в том числе антигенпрезентирующими) и запускать цепочку клеточных и гуморальных реакций, которые и будут приводить к отторжению трансплантата. Антигенпрезентиующие клетки распознают аллоантигены и включают их в молекулу главного комплекса гистосовместимости. В-лимфоциты так же могут поглощать, а затем передавать связанные с иммуноглобулинами антигены Т-лимфоцитам через главный комплекс гистосовместимости. Это запускает клеточную пролиферацию и образование клонов CD4+ Т-клеток, т.е. активацию Т-лимфоцитов. Затем под влиянием IL-2, IL-7 и IL-15 и других цитокинов CD4+ лимфоциты будут дифференцироваться на две субпопуляции – Т-хелперов первого (Th1) и второго типов (Th2). Th1 будут обеспечивать развитие клеточного иммунного ответа, а Th2- гуморального [19].
Клеточно-опосредованное отторжение играет большую роль в реакциях острого отторжения. Основной механизм заключается в усилении адаптивной иммунной системы из-за увеличения площади повреждения эпителиальных клеток. Из-за формирования иммунологической памяти будет снижаться толерантность организма реципиента к аллотрансплантату и, как следствие, ухудшаться качество функционирования трансплантата [20]. Выделяют два пути формирования иммунологической памяти: сенсибилизация реципиента после гемотрансфузий, беременностей и трансплантаций и процесс, запускаемый лимфопенией для восстановления популяции Т-лимфоцитов (гомеостатическая пролиферация). После ограничения процесса снижения количества белых кровяных клеток с помощью химиотерапии будет происходить восстановление аллореактивных девственных Т-клеток и Т-клеток памяти – популяции иммунокомпетентных клеток [21]. Отличительная черта T-клеток памяти в том, что для их активации не нужен будет второй со-стимулирующий сигнал. Внутри группы этих клеток выделяют две субпопуляции: центральные и эффекторные. Первые локализуются в слизистых оболочках и периферических лимфатических узлах. В отличие от эффекторных, центральная субпопуляция Т-клеток памяти синтезирует цитокины в очень малых количествах, но поддерживает состояние иммунологической памяти за счет высокой способности к пролиферации.
Эффекторные Т-клетки образуют на своей поверхности хемокиновые рецепторы, с помощью которых клетки поступают в ткани, где происходит реализация их функций [22]. Кроме того, выделяют еще один тип Т-лимфоцитов – регуляторные Т-клетки. Они способствуют возникновению иммунной толерантности, а также поддерживают ее, что играют решающую роль в аутоиммунитете и трансплантации [23].
Несмотря на то, что Т-клетки являются частью адаптивной иммунной системы, врожденная иммунная система за счет индуцирования воспалительных реакций, выработки веществ, которые направляют миграцию клеток помогают в осуществлении контакта Т-хелперов с антигеном. Так проявляется тесная взаимосвязь между двумя иммунными системами.
Реакции гуморального иммунитета больше характерны для хронического антитело-опосредованного отторжения почечного трансплантата. Оно является основной причиной потери трансплантата на поздней стадии. Активация В-лимфоцитов во многом схожа с активацией Т-лимфоцитов, но их процесс дифференцировки сопровождается перестройкой сегментов иммуноглобулинов. Внешние факторы, такие как интерлейкины и поверхностные белки будут способствовать эволюции В-клеток от про-В-клеток до незрелых В-клеток, которые мигрируют в лимфатические узлы и селезенку для дальнейшего созревания в плазматические клетки, продуцирующие антитела.
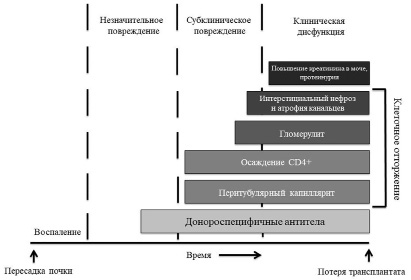
Рис. 2. Антитело-опосредованное отторжение трансплантата (Hajime Sasaki, Tatsu Tanabe, Takahiro Tsuji, Kiyohiko Hotta. Mechanism and treatment for chronic antibody-mediated rejection in kidney transplant recipients. 2023)
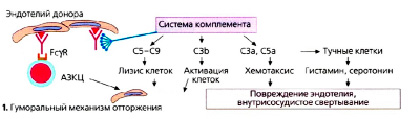
Рис. 3. Роль системы комплемента в гуморальном механизме отторжения трансплантата
Сначала девственный В-лимфоцит взаимодействует с антигеном, который связан с рецептором В-клетки. Это приводит к активации процессинга антигена и его презентации на главный комплекс гистосовместимости. После этого Т-хелперы запускают дифференцировку В-лимфоцитов либо в плазматические клетки, продуцирующие низкоаффинные антиген-специфические антитела, либо в В-клетки памяти. Донор-специфические антитела (ДСА) являются основной причиной антитело-опосредованного отторжения (рис. 2).
Для образования ДСА необходимо развитие воспалительного процесса, например, появление инфекционного агента в тканях трансплантата. Это приведет к повышению экспрессии антигенов гистосовместимости на эндотелии сосудов, что поспособствует дифференцировке В-клеток в плазмоциты на фоне ускорения их аллогенного ответа. Следующей стадией будет синтез плазматическими клетками ДСА. Пока ДСА не провзаимодействует с эндотелием сосудов, повреждая его с помощью активации комплимента (рис. 3), патология будет клинически не выражена. Воспалительные процессы в микрососудистом русле, например васкулиты, перитубулярные капилляриты, приведут к развитию интерстициального фиброза и атрофии канальцев за счет прогрессирующего нарастания соединительной ткани. Эти процессы в конечном итоге будут ухудшать функцию трансплантата.
Трансплантация является наиболее оптимальным методом почечно-заместительной терапии при ХБП. Однако ввиду генотипических различий между донором и реципиентом возможно развитие реакции отторжения и дисфункции трансплантата, что может привести к возникновению гломерулита, перитубулярного капиллярита, васкулита, трансплантационной гломерулопатии, интерстициального фиброза и атрофии канальцев. Неблагоприятный исход этих патологий будет заключаться в замещении функциональной ткани соединительной и развитию склероза. Характер течения осложнений зависит от объема, длительности иммуносупрессивной терапии, которая увеличивает риск онкоосложнений, устойчивости организма к инфекционным агентам.
Заключение
Таким образом, проведя анализ научной литературы по теме исследования, можно выявить необходимость дальнейшего совершенствования фармакологических препаратов, влияющих на иммунитет. Также важно уделять внимание появлению инфекций у больных с определенными факторами риска, что возможно позволит улучшить результаты аллотрансплантации почек.
Библиографическая ссылка
Кабанова С.Н., Ануфриева Е.И., Макеева А.В., Болотских В.И. РОЛЬ ИММУННОЙ СИСТЕМЫ В ВОЗНИКНОВЕНИИ ОСЛОЖНЕНИЙ ПОСЛЕ АЛЛОТРАНСПЛАНТАЦИИ ПОЧКИ // European Journal of Natural History. 2024. № 6. С. 17-22;URL: https://world-science.ru/ru/article/view?id=34407 (дата обращения: 07.02.2026).

